Hedeflenen tedavilerdeki ilerlemelere rağmen, meme kanseri hastalarının% 70'inden fazlası tedaviden sonraki beş yıl içinde kanser nüksetmesi. Bir tür hedefli tedavi olan lapatinib, hastalar trastuzumab adı verilen HER2-pozitif meme kanserini seçici olarak hedefleyen başka bir tedaviye yanıt vermeyi bıraktıktan sonra kullanılan bir tedavi direği olmuştur. Ancak, lapatinib'e direnç kaçınılmaz olarak gelişir ve hastalar sınırlı seçeneklerle karşı karşıyadır. Dirençli mekanizmaların önceki çalışmaları anormal DNA değişikliklerine veya anormal gen ekspresyon paternlerine odaklanmıştır, ancak kanserler sadece genetik kodumuzdaki değişikliklerden kaynaklanmaz.
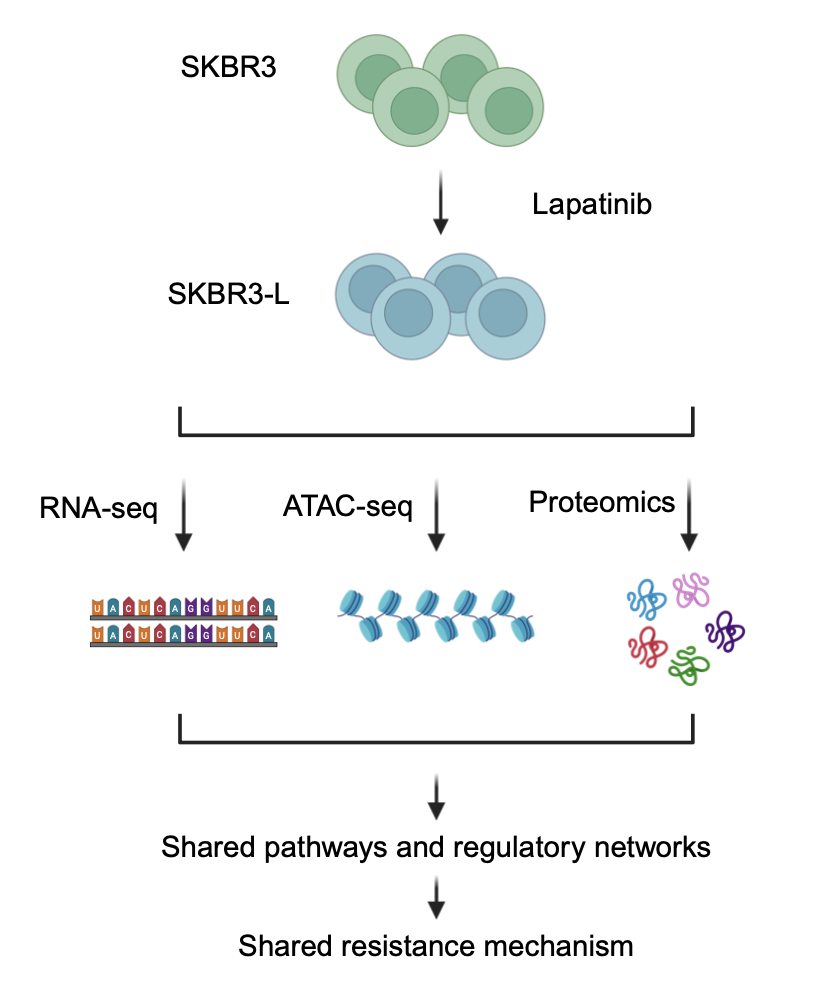
Genom, epigenom ve proteom dinamik ve bazen öngörülemeyen yollarla etkileşime girer ve üç katmanı birlikte inceleyerek hangi içgörülerin ortaya çıkabileceğini görmek istedik. HER2-pozitif meme kanseri hücreleri (SKBR3 hücreleri) ve lapatinib dirençli muadilleri (SKBR3-L) model sistemini seçtik. Fikrimiz basit ama iddialıydı: Kanser biyolojisini yüksek çözünürlükte çoklu katmanlarda sorgulayabilen en son üç tekniği birleştiren bütünleştirici bir “çok omik” stratejisi kullanın. Dirençin nasıl geliştiğinin tam resmini yakalamak için kromatin erişilebilirlik profili (DNA'nın nasıl açıldığını ”ve“ kapattığını ”, gen ekspresyonu değişimlerini ve protein bolluğunu (kütle spektrometresi bazlı proteomikler) kullandık. Bu yaklaşım, olağan tek katmanlı çalışmaların ötesine geçmemizi sağladı; Üç moleküler haritayı kaplayarak, en sağlam ve tutarlı değişiklikleri, gerçek direnç sürücüleri olma olasılığı en yüksek olanları tanımlayabiliriz.
Geleneksel anlayış, agresif kanser hücrelerinin kromatinlerini açarak daha tehlikeli hale geldiğini ve kansere neden olan genleri transkripsiyon için erişilebilir hale getirdiğini göstermektedir. Sürprizimize göre, dirençli hücreler tam tersini gösterdi: kromatin (DNA) erişilebilirliğinde küresel bir azalma. Bu bulgu başlangıçta bizi şaşırttı-genomlarının büyük bölümlerini kapatıyorlarsa hücreler nasıl daha invaziv ve ilaca dirençli hale gelebilir? Bununla birlikte, her veri kümesine ve her geni derinlemesine araştırdığımızda cevap netleşti. Genel kromatin erişilebilirliği azalırken, transkripsiyon başlangıç bölgelerinin yakınındaki spesifik anahtar bölgeler oldukça açık kalmıştır. Bu bölgeler, her üç veri kümesinde sürekli olarak yukarı regüle edilen genlere karşılık geldi – arka plan gürültüsünden göze çarpan bir direnç “imzası”.
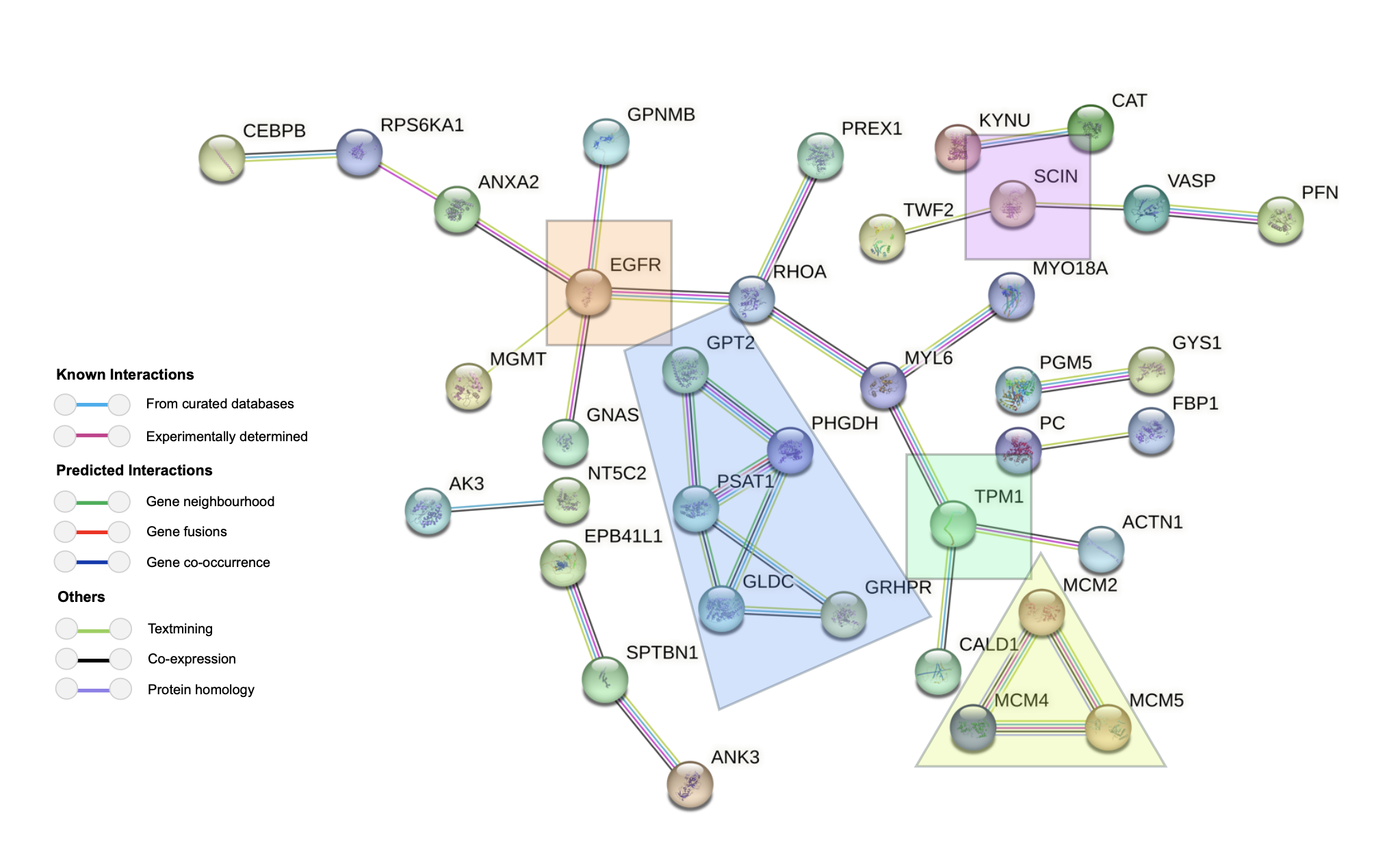
Üç veri kümemizin üst üste binmesinden, dirençli hücrelerde sürekli olarak değiştirilmiş dokuz belirteç belirledik. EGFR ve SCIN zaten meme kanseri direncinde bilinen oyunculardı, bu da bize yaklaşımımızın anlamlı sonuçlar yakaladığına dair güvence verdi; Ancak HPGD, FASN, TPM1, CALD1, PCP4, AKR7A3 ve KRT81 dahil olmak üzere yedi yeni aday daha heyecan verici. Bu genlerin birçoğu daha önce HER2-pozitif meme kanseri veya lapatinib direnciyle bağlantılı olmamıştı. İşlevleri, aktin yeniden şekillendirme, metabolik yeniden programlama ve stres yanıtı gibi süreçleri vurguladı, bunların hepsi kanser hücrelerinin tedaviye uyum sağlamasına yardımcı olabilir. Bağımsız bir akciğer kanseri hücre modelinde bu belirteçlerden ikisini (FASN ve HPGD) doğruladığımızda, edinilmiş lapatinib direnci sırasında da yukarı regüle edildiğini bulduk. Bu, ortaya çıkardığımız direnç imzasının sadece meme kanserinde değil, farklı kanserlerde paylaşılabileceğini düşündürmektedir.
Dirençli hücrelerin davranışına bakıldığında, çok omik verilerin önerdiklerini güçlendirdi. Uyuşturucuya duyarlı meslektaşlarıyla karşılaştırıldığında, dirençli hücreler daha düzensiz, daha az küreseldir ve 3D kültürde büyüdüğünde invaziv çıkıntılar göstermiştir. Yumuşak agar analizlerinde, dirençli hücreler hayatta kaldıkça ve her zamanki büyüme alışkanlıklarından daha yeni ve farklı mikro ortama daha iyi adapte oldukça daha büyük ve daha agresif koloniler, dönüşüm ayırt edici özellikleri oluşturdular. Bu morfolojik değişiklikler, OMICS verilerinde tanımladığımız yolların zenginleştirilmesiyle, özellikle epitelyal -mesenkimal geçiş (EMT), KRAS/MAPK sinyali ve DNA onarımı ile ilgili olanlar ile uyumludur. Başka bir deyişle, dirençli hücreler kendilerini birden fazla seviyede yeniden kabloyu yeniden sarıyordu ve özel, invaziv bir hayatta kalma modu için bazı gen ekspresyonu esnekliklerini alıyordu.
Bulgularımız, ilaç direncini incelerken mutasyonların ötesine bakmanın önemini vurgulamaktadır. Kromatin değişiklikleri gibi epigenetik değişiklikler, kanser hücrelerini tedavi etmelerini zorlaştıracak şekilde yeniden programlayabilir. Belirlediğimiz dokuz işaretleyici direnç imzası, bilimsel topluluğa hangi hastaların nüks riski altında olduğunu tahmin etmek için yeni biyobelirteçler geliştirmek için daha fazla araştırma teşviki sağlayabilir ve eğer doğrulanırsa, belirli yollara dirençli hücreleri kesintiye uğratan hedeflenmiş tedaviler tasarlamak, entegrasyonlu çoklu omik yaklaşımları farklı kanserler ve tedaviler arasında daha geniş bir şekilde uygulamak. Sonuçta, umut, direnişin artık kaçınılmaz bir sonuç olmayacağı, daha ziyade önlenebilecek öngörülebilir bir süreç olacağıdır.
Bir yanıt yazın