Alkol: Alkolle ilişkili karaciğer hastalığının sürücüsü
Aşırı alkol alımı, dünya çapında kronik karaciğer hastalığı için önde gelen risk faktörü olmaya devam etmektedir ve karaciğerle ilişkili mortalitenin önemli bir nedeni ve nakil ihtiyacının önemli bir nedenidir, ancak etkili tedaviler eksiktir. Etanol kaynaklı patolojinin temel faktörleri arasında alkol metabolizması, konak genetik duyarlılık ve organlar arası eksenlerin, özellikle bağırsak-kara, bağırsak-akın ve bağırsak yollarının bozulması yer alır.
Alkolle ilişkili karaciğer hastalığında bağırsak-karaciğer ekseni
Ortaya çıkan kanıtlar, alkolle ilişkili karaciğer hastalığında (ALD) bağırsak homeostazının merkezi rolünün altını çizmektedir. Mikrobiyal bileşim ve bolluk, epitel bütünlüğü, mukus tabaka yapısı ve mukozal bağışıklık tepkilerindeki değişiklikler bağırsak bariyeri fonksiyonunu toplu olarak tehlikeye atar. Bu artan bağırsak geçirgenliği, bakterilerin ve mikrobiyal antijenlerin karaciğere taşınmasına izin vererek ALD'yi şiddetlendiren kronik inflamasyonu tetikler. Bağırsak karaciğer ekseninin bozulmasının altında yatan karmaşık moleküler mekanizmaları anlamak, bu durumu önlemek ve tedavi etmek için yenilikçi stratejiler geliştirmek için çok önemlidir.
Mikrobiyom
Bağırsak mikrobiyotasında, artan değişiklikler Enterococcus ve azaltılmış yararlı bakteriyel ve azaltılmış mantar çeşitliliği, ALD şiddeti ile ilişkilidir. Patojenike karşı bakteriyofaj tedavisi de dahil olmak üzere mikrobiyomu hedefleyen ortaya çıkan tedaviler Enterococcus fekal ve fekal mikrobiyota transplantasyonu, söz ver. Etanol ayrıca, mikrobiyal metabolit işleme ve safra asidi metabolizmasında yer alan çoklu mikrobiyal moleküler yolları da ortadan kaldırarak ALD yönetimi için yeni terapötik fırsatlar sunan karmaşık mekanizmaları vurguluyor.
Bağırsağın hücresel bileşenleri
ALD'nin patofizyolojisini anlamak, etanolün bağırsak homeostazını düzenleyen bireysel hücre popülasyonları üzerindeki etkileri hakkında ayrıntılı bir fikir gerektirir.
Bağışıklık sistemi. Bağırsak homeostazı, fiziksel, kimyasal ve bağışıklık savunmaları arasında sıkı bir şekilde düzenlenmiş bir etkileşimin yanı sıra komşulara ve diyet antijenlerine karşı bağışıklık toleransına bağlıdır. Bağırsak ikamet eden bağışıklık hücrelerinin çeşitli ağı bu dengeyi korur. Alkol, salgı immünoglobulin A'yı (SIGA) bozarak, dendritik hücre ve makrofaj popülasyonlarını değiştirerek G'yi azaltarak bu bağışıklık manzarasını bozarRoup 3 doğuştan gelen lenfoid hücreler (ILC3)/IL-22 sinyali ve iltihaplanmaya yönelik T hücresi tepkileri. Bu değişiklikler bağışıklıktan, bariyer bütünlüğünü, mikrobiyal translokasyonu arttırır ve karaciğer iltihabını şiddetlendirir.
Enterik sinir sistemi (ENS). ENS, enterik nöronlardan ve glial hücrelerden oluşur. Bağırsak motilitesini, salgılama, emilim ve nöro-immün etkileşimleri düzenler. ALD'de, kronik etanol maruziyeti çoklu mekanizmalar yoluyla ENS fonksiyonunu bozar. Bağırsak mikrobiyotası, alkol kötüye kullanımı sırasında değiştirilen serotonin, dopamin, gama-aminobutirik asit (GABA) ve glutamat dahil olmak üzere çeşitli nörotransmitter üretir.
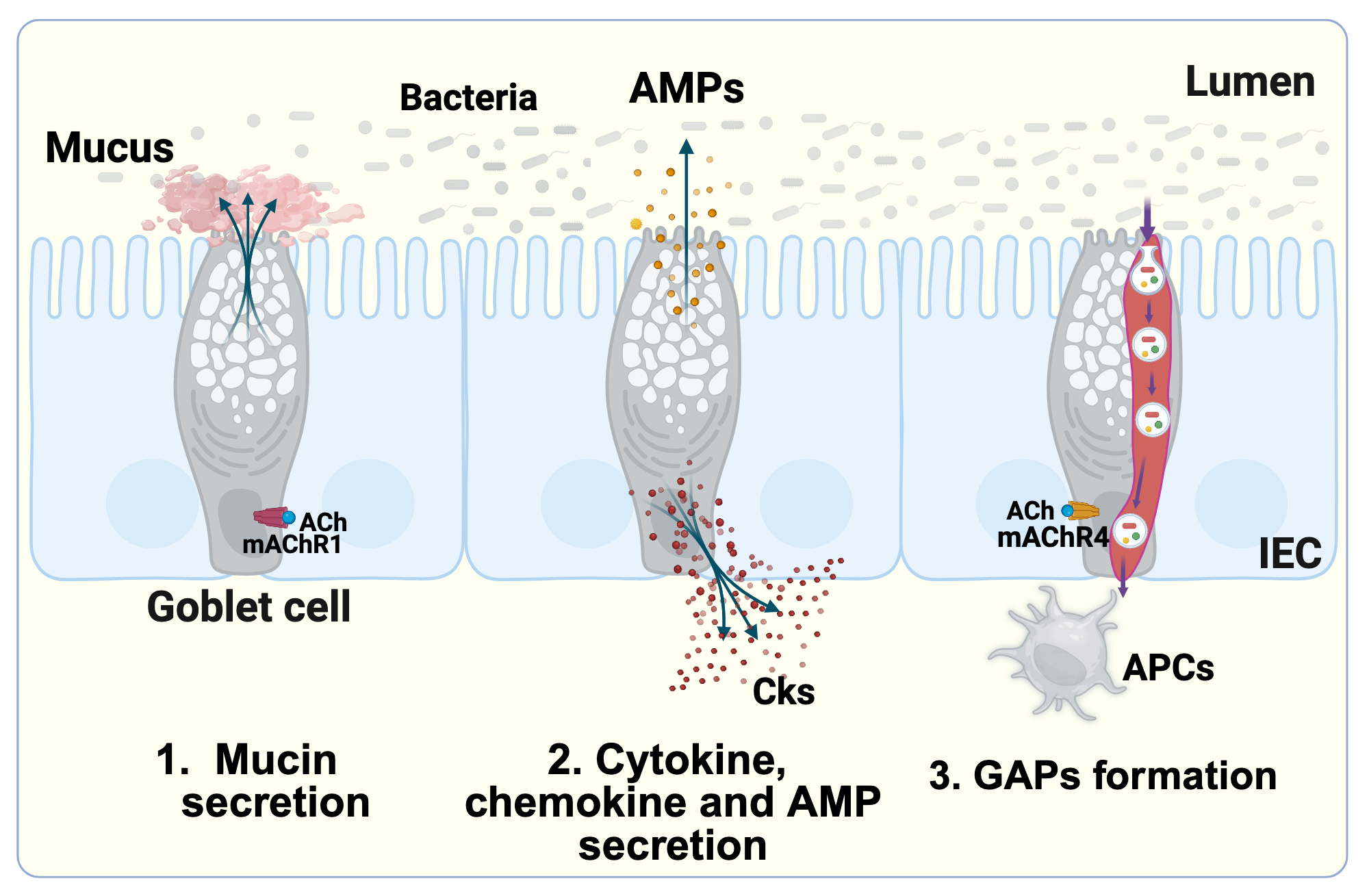
Bağırsak epitelyumu. Enterositler, Paneth hücreleri, goblet hücreleri, kök hücreler, mikrofold (M) hücreleri, enteroendokrin hücreler ve Tuft hücreleri dahil olmak üzere özel bağırsak epitel hücreleri (IEC'ler) bağırsak bariyeri bütünlüğünün merkezidir ve hepsi ALD'de önemli ölçüde etkilenir. ALD'de, enterositler, sıkılmış sıkı kavşaklar, bozulmuş IgA taşınması ve antimikrobiyal peptit (AMP) sekresyonu sergiler, bu da bağırsak geçirgenliğinin artmasına ve mikrobiyal translokasyona yol açar. Paneth hücreleri, bakteriyel kontrolden ödün vererek azaltılmış AMP üretimi (örn., Reg3, a-defensinler) sergiler. Goblet hücreleri etanole yanıt olarak müsin sekresyonunu arttırır, ancak bu AMP'nin bakterilere erişimi engelleyebilir. ALD ayrıca bağırsak kök hücre yenilemesini bozar ve epitel rejenerasyonunu zayıflatır. Enteroendokrin hücreler, metabolizmayı etkileyen ALD'de değiştirilmiş hormon profilleri (örn., Somatostatin azalmış) gösterir.
ALD'de goblet hücre disfonksiyonu
Goblet hücreleri, esas olarak salgılanan mukin MUC2'den oluşan bağırsak epitelyumu üzerinde koruyucu bir mukus tabakası oluşturan müsin glikoproteinleri üretir. Müsin sekresyonuna ek olarak, goblet hücreleri bağışıklık düzenlemesinde merkezi bir rol oynar. Mukozal homeostazın korunmasına yardımcı olan direnç benzeri molekül beta (Relmy) ve trefoil faktörü aile peptit 3 (TFF3) dahil olmak üzere sitokinler, kemokinler ve antimikrobiyal peptitler salgılarlar. Ayrıca, goblet hücreleri, lüminal antijenleri örnekleyerek ve bunları lamina propria'da goblet hücre ile ilişkili antijen pasajları (GAPS) olarak bilinen özel yapılar aracılığıyla antijen sunan hücrelere (APC'ler) ileterek bağışıklık sürveyansına katkıda bulunur ve böylece adaptif bağışıklık tepkilerini destekler.
ALD'de goblet hücre fonksiyonu ve müsin dinamikleri bozulur. Alkol kötüye kullanımı mukus kalınlığını, goblet hücre sayılarını ve müsin üretimini arttırır. Fucosiltransferaz 2'nin (FUT2) aracılık ettiği bir işlem olan a1-2-fucosilasyon yoluyla müsinlere a-l-fucosidaz eksprese eden bağırsak bakterileri için bir enerji kaynağı görevi gören bir şeker olan fukoz eklenir. AUD hastalarında FUT2, mikrobiyal homeostazı bozarak ve karaciğer hasarına karşı artan duyarlılığı bozarak aşağı regüle edilir. Gibi yararlı müsin bozucu bakterilerin kaybı Akkermansia Musiniphila Ayrıca, mikrobiyal translokasyon ve iltihaplanmayı destekleyerek bariyer fonksiyonunu tehlikeye atar. Fukosilasyon ve mikrobiyom restorasyonunu hedefleyen ortaya çıkan klinik öncesi tedaviler vaat eder. Gelecekteki araştırmalar, bağırsak homeostazını geri kazanmak ve ALD sonuçlarını iyileştirmek için bu bulguları mikrobiyom bazlı tedavilere dönüştürmeye odaklanmalıdır.
Goblet hücre ile ilişkili antijen pasajları (boşluklar) ve bağırsak immün homeostazı
Boşluklar, lamina propria'daki APC'lere lüminal antijenlerin kontrollü olarak verilmesini kolaylaştıran ağ geçitleri olarak işlev gören özel pasajlardır. Bağırsak lümen ve bağışıklık sistemi arasında seçici iletişimi sağlayarak, boşluklar diyet antijenlerine bağışıklık toleransının arttırılmasında önemli bir rol oynar ve aynı zamanda zararlı patojenleri tanımak ve etkili bir şekilde yanıtlamak için eğitir.
Temel özellikler ve mekanizmalar:
- Boşluk oluşumu ve işlevi: Boşluklar esas olarak muskarinik ACh reseptörlerine bağlanan asetilkolin (ACH) ile tetiklenen ince bağırsakta oluşur (ince bağırsakta Machr4, distal kolonda Machr3). Bu süreç, PI3K, aktin ve mikrotübüllere bağlı endositik vezikül kaçakçılığını içerir. Lüminal antijenler, iki farklı mekanizma yoluyla goblet hücreleri boyunca taşınır: endositik vezikül aracılı alım ve transsitoz, bağışıklık sürveyansı için lamina propria-APC'lere (APC'ler) iletilmelerini sağlar. Patojen yayılmasını önlemek ve diyet antijenlerine verilen yanıtları sınırlamak için Salmonella typhimurium gibi enterik enfeksiyon sırasında boşluklar kapatılır.
- Bölgesel farklılıklar: Boşluklar ince bağırsakta bol miktarda bulunur, ancak çoğunlukla bakteriyel yoğunluğun daha yüksek olduğu kolonda kapalıdır ve aşırı bakteriyel translokasyonu önler. Kolon boşluğu oluşumu, miyeloid farklılaşma primer tepkisi 88 (MyD88), epidermal büyüme faktörü reseptörü (EGFR) ve mitojen ile aktive edilen protein kinaz sinyal yolu (MAPK) sinyalini içeren mikrobiyal algılama yolları ile inhibe edilir, kolon antibensinin örneklemesini koruyan, antibiyotikler, kuziğin söndürülür.
- Bağışıklık cell Etkileşimler: Boşluklar, antijenleri öncelikle bağırsak bağışıklık toleransını ve homeostazını korumanın anahtarı olan düzenleyici T hücrelerini (Tregs) indükleyen CD103+ dendritik hücrelere (DC'ler) verir. GAPS, baskılayıcı bir mukozal ortamını destekleyerek IL-10 ve retinoik asitin APC üretimini arttırır.
Çalışmamız: Machr4, boşluk kaynaklı antimikrobiyal bağışıklık yoluyla karaciğer hastalığını bastırır
Çalışmamız, Machr4 aktivasyonuna yanıt olarak oluşan küçük bağırsak boşluklarının mukozal bağışıklık gözetimini sürdürmek ve karaciğere mikrobiyal translokasyonu sınırlamak için gerekli olduğu kritik bir mekanizmayı ortaya koymaktadır.
-
Alkol MA'yı bozarChr4-GAP aracılı bariyer fonksiyonu. Hem insanlarda hem de farelerde kronik alkol maruziyeti Machr4 ekspresyonunu ve ilgili yol transkriptlerini aşağı regüle ederek boşluk oluşumunun azalmasına neden olur. Machr4 downregülasyonu AUD hastalarında ALD ilerlemesi ile güçlü bir şekilde ilişkilidir. Klinik öncesi modellerimiz, boşluk kapanmasına MAPK aracılığıyla aracılık ettiğini göstermektedir. Bu, LP-APC'ler tarafından antijen örneklemesini bozarak, antimikrobiyal bağışıklığı (REG3) zayıflatarak ve ALD ilerlemesinin önemli bir itici gücü olan patojenik bakteriyel translokasyonu kolaylaştırarak bariyer fonksiyonunu bozar.
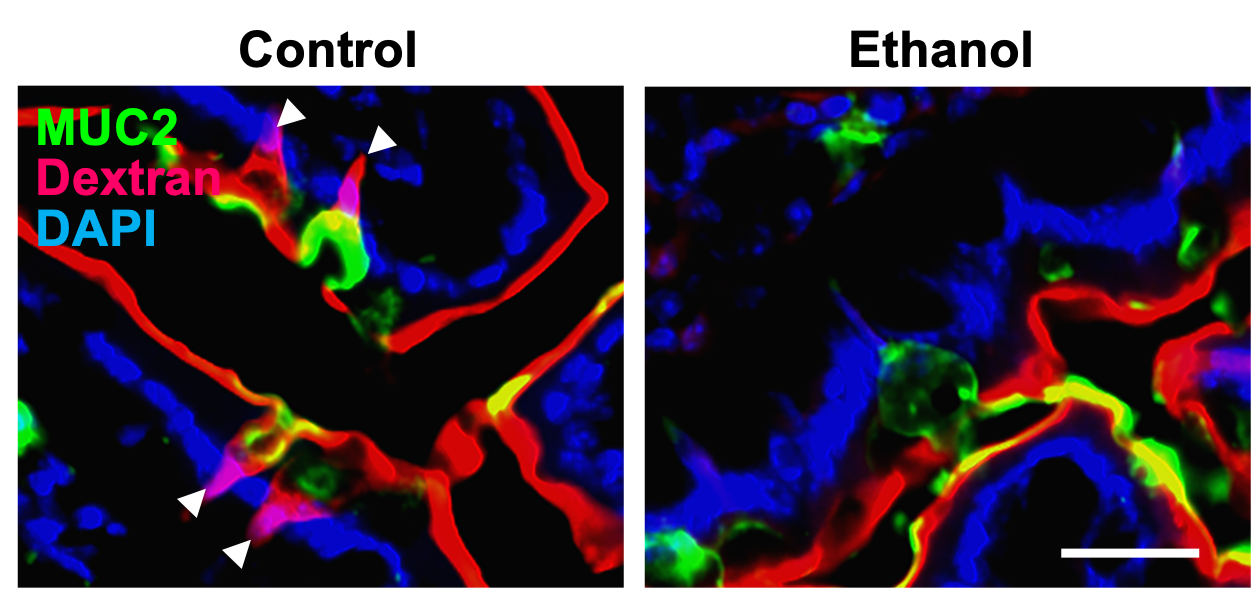
Alkol MACHR4 ve GAP oluşumunu azaltır. Llorente ve ark., Doğa2025
-
Boşluğa bağlı bağışıklık kaskadı korumayı geri yükler. Lüminal antijenleri örnekleyen ve koruyucu, APC aracılı bir bağışıklık tepkisi başlatan boşluk üretimini içeren yeni ve kritik bir moleküler mekanizma tanımlıyoruz. APC'ler, IL-22 üretimini ILC3'ler tarafından teşvik ederek IL-23 salgılar. IL-22 daha sonra antimikrobiyal reg3 lektinleri indüklemek için IEC'ler ve Paneth hücreleri üzerinde hareket eder. Özetle, boşluklar → LP-APC'ler → IL-23 → ILC3S → IL-22 → Reg3 ekseni mukoza ile ilişkili bakterileri sınırlar, karaciğere bakteriyel translokasyonu önler ve etanol kaynaklı karaciğer hasarına karşı korur.
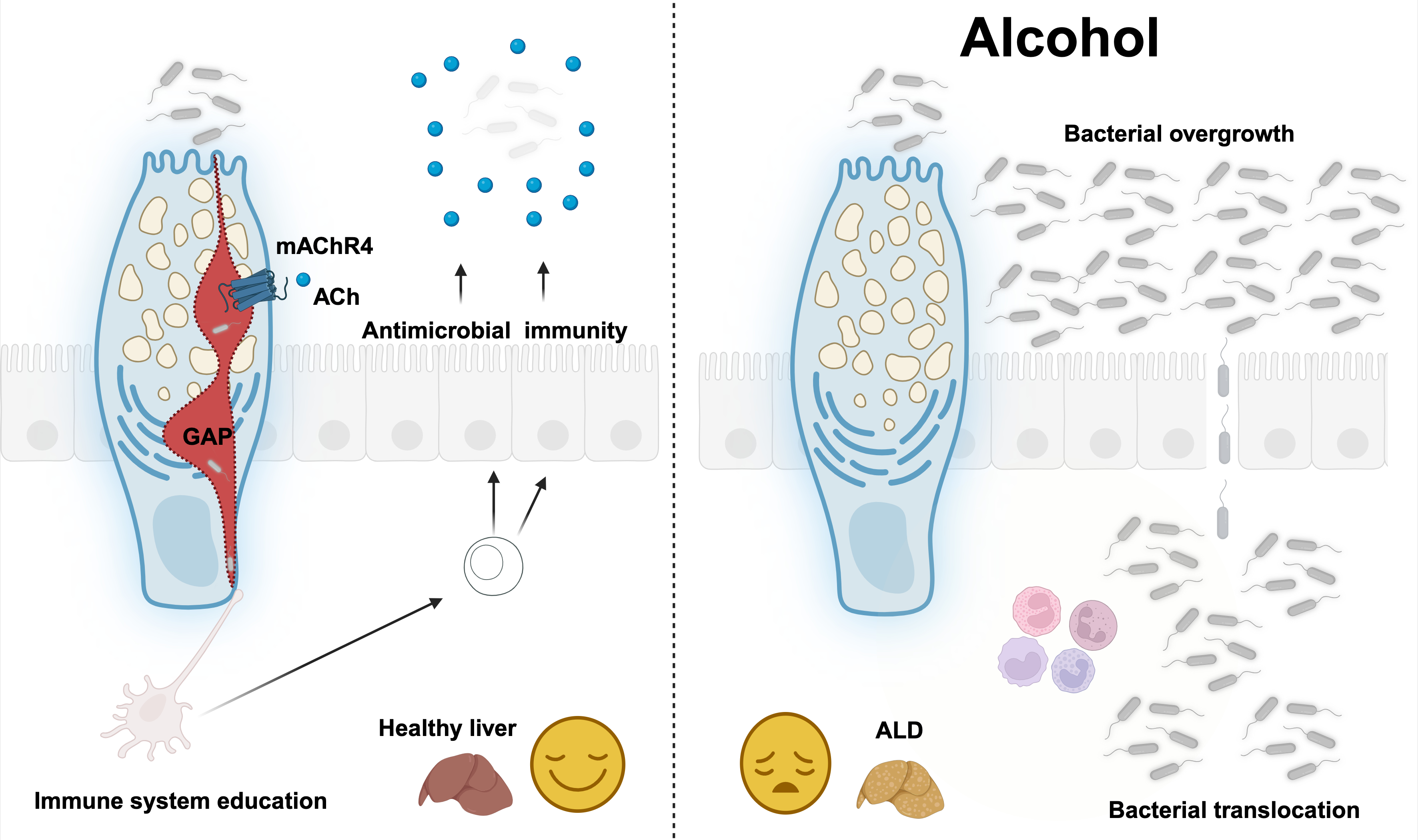
Boşluklar, bağırsak bağışıklık sistemini eğiterek ve reg3b/g antimikrobiyal peptitleri uyararak lamina propria antijen sunan hücrelere lüminal antijenler verir. Biorender'den bir lisansla oluşturulan şekil. -
Bağırsak IL6st-indüksiyonD GAP Oluşumu. IEC'ye özgü IL6ST aktivitesi ile genetik modeller, ince bağırsak organoidlerinin ve enterik nöronların sofistike bir ko-kültür sistemi ile birleştirildiğinde, artan (işlev kazancı) veya azaltılmış (işlev kaybı) kullanılarak, IL6ST/GP130 sinyalinin Machr4 yolu aktivasyonu yoluyla GAP oluşumunu teşvik ettiğini gösteriyoruz.
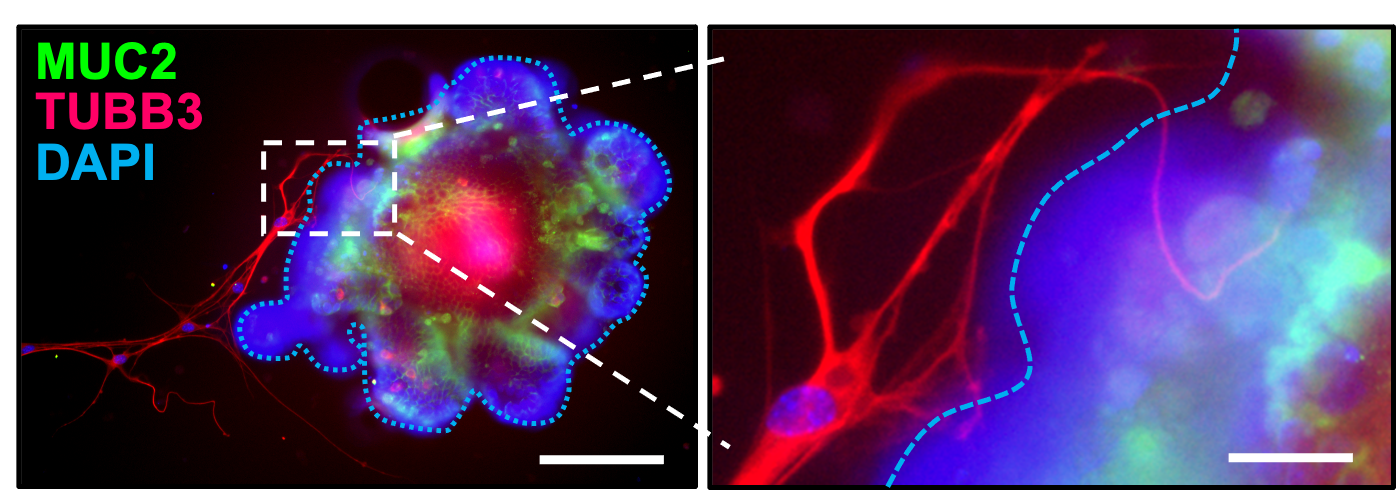
Enterik nöronları olan fare SI organoidleri birlikte kültürlendi. Llorente ve ark., Doğa2025 - Machr4 yolu İndüksiyon ALD'yi önler. Machr4'ü, kemojenetik olarak veya IL6ST sinyali yoluyla aktive etmek, bu bağışıklık kaskad devresini geri yükler, bakteriyel translokasyonu azaltır ve etanol kaynaklı steatohepatiti önler.
- ALD'deki boşlukların koruyucu rolünün ilk gösterimi. Machr4'ün goblet hücresine özgü manipülasyonumuz, bağırsak homeostazı ve karaciğer hastalığındaki boşluklar için doğrudan immünoprotektif bir rol oluşturan ilk kişidir. Bu bulgular goblet hücrelerini bağırsak karaciğer ekseninde anahtar bağışıklık nöbetçileri olarak yeniden tanımlar ve ALD için terapötik bir kontrol noktası olarak konum boşluğu oluşumunu konumlandırır.
-
Seçici ACHR4 Pozitif Allosterik Modülasyon (ACHR4 PAM), ALD için umut verici bir tedavi. Bir Machr4 PAM ile boşluk oluşumunun geri yüklenmesi, hastalığın kötüleştiği hem WT hem de IEC'ye özgü gp130 eksik farelerde mikrobiyal translokasyonu ve etanol kaynaklı steatohepatiti önler.
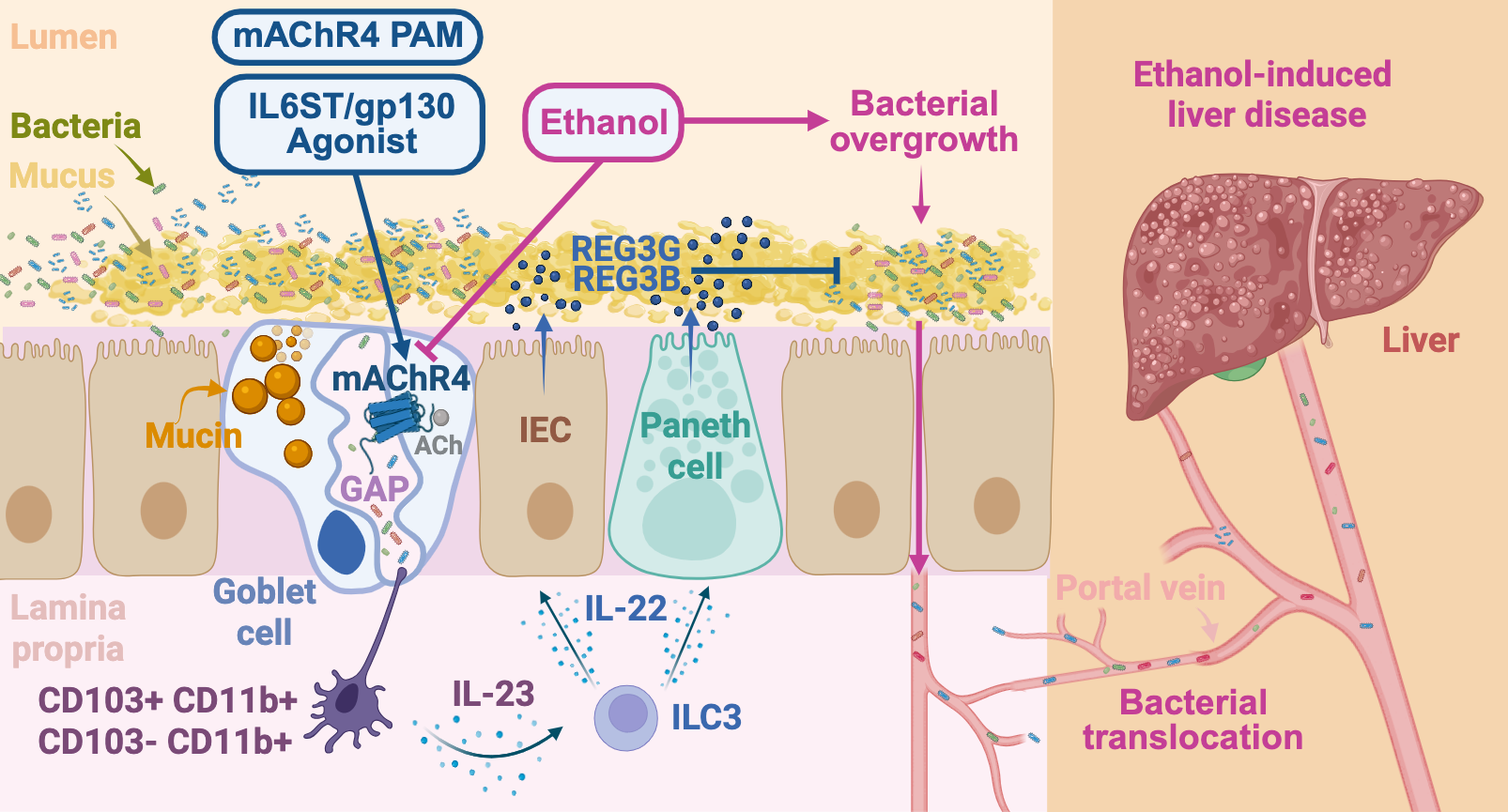
IL6ST/GP130 aktivasyonu, MACHR4 pozitif allosterik modülasyon (PAM) veya kemogenetik GC'ye özgü Machr4 aktivasyonu yoluyla boşluk oluşumunun arttırılması, antijen sunan hücrelerin (APC'lerin (APC'lerin) genişlemesini ve fonksiyonunu güçlendirir, bağırsak bariyer fonksiyonunu güçlendirir ve etanol-artan mukosal bakteri ve translokasyon yoluyla önlenir. GAP-APCS-ILC3-IL-22-REG3B/G ekseni ve Treg aracılı yanıtlar. Biorender'den bir lisansla oluşturulan şekil. Llorente ve ark., Doğa2025 -
Klinik potansiyel ve gelecekteki talimatlar: ALD ve AUD için ikili alaka düzeyi
Önceki çalışmalar Machr4'ün dorsal striatumun bir beyin bölgesi olan putamende aşağı regüle edildiğini göstermiştir. Machr4 yolunun farmakolojik allosterik modülasyonu, kemirgenlerde etanol ve kokain arama ve tüketimi azaltırken, Machr4 eksikliği ilaç kendi kendine uygulanmasını arttırır. Bu, Machr4'ü aynı anda ALD ve AUD'yi önleme potansiyeli olan umut verici bir çift terapötik hedef olarak konumlandırır. Özellikle, birkaç Machr4 agonisti şizofreni için klinik çalışmalarda bulunmaktadır. Çalışmamız, Machr4 Pathway agonizmini ALD'ye karşı koruma ile ilişkilendiren ve bu ajanları hem AUD hem de Ald – her iki kritik, karşılanmamış küresel sağlık zorluklarını ele almak için yeniden kullanma fırsatını vurgulayan ilk kişidir.
Bir yanıt yazın