İndüksiyon için optimal bir interaktomu hedefleyen yapısal hücre-otonom yanıtına nasıl müdahale edileceğinin bir düzenlemesi olarak doku/mikro çevre kontrolünün sunulması göz korkutucu olmuştur. Şu anda tasarlandığı şekliyle farmakolojiye meydan okuyor ve çoğu kişiye yabancı olan saf bir sözlüğe sahip yeni, çok değerlikli mekanik yeniden ifadeler gerektiriyor.
Doğuştan gelen bağışıklıktaki direnç keşifleri ayrı bölümlerde anlatılmış ve hiçbir zaman kapsamlı bir şekilde açıklanmamıştır. “İleri iyileşme için hücrenin otonom yanıt penceresi”, yanıtın direncin geç inflamatuar bileşenlerini (adaptif bağışıklık) çağırmasından çok önce, bu tür bilgileri derlemek ve kolektif olarak nasıl çalıştığını açıklamaya yönelik ilk girişimdir. Böyle bir görüş sağlam temel bilime ve güçlü klinik kanıtlara dayanmaktadır, ancak kurucu mekanik yapının bazı yönlerinde hücre ve moleküler araştırmalarda doğrulamadan yoksundur. Daha fazla gelişmeyle, böyle bir seviyedeki açıklamanın teorik moleküler yön ile tutarlı olması ümit edilmektedir.
Doğuştan gelen bağışıklık yapısıyla ilgili makaleyi yazmaya güçlü bir motivasyon sağlayan kanıtlar, ilk araştırmalarda gözlemlenen ve kliniğe aktarılan ideal rejeneratif iyileşme sonuçlarından ve yaralı dokularda fark edilen hem oldukça açık hem de benzeri görülmemiş enfeksiyona karşı müthiş savunmadan oluşuyordu. İlk kanıt satırı makalede ayrıntılı olarak açıklanmaktadır. Ancak makalede yer almayan, doğuştan gelen bağışıklığın antimikrobiyal savunmasına ilişkin yeni kanıtlara atıfta bulunulmakta ve aşağıda kısaca tartışılmakta, yaralı dokunun enfeksiyonla mücadele ettiği ve enfeksiyondan uzak kaldığına dair kapsamlı bulgulara sağlam bir doğrulama eklenmektedir.
Onlarca yıldır, proteazom bozulmasından türetilen peptitlerin birincil fonksiyonunun, adaptif T hücresi bağışıklığını başlatmak için ana doku uyumluluk kompleksi sınıf I tarafından antijen sunumu olduğuna inanılıyordu. Ancak son on yılda yapılan araştırmalar, fonksiyonun, proteomik bileşim ve fonksiyondaki değişikliklerin neden olduğu ve patojenler tarafından en sonunda patojenin zarını delerek bakteriyel büyümenin durdurulmasına neden olan bu katyonik fraksiyonların ekstraksiyonunu indükleyen daha fazla triptik proteozomal bozunma yoluyla, düşünülemez bir ölçek ve çeşitlilikte katyonik özelliklere sahip antimikrobiyal peptitlerin üretimine kadar uzandığını açıklığa kavuşturdu; uyarlanabilir katılım olmadan ve hala ilk savunma hattında (2) .
2011 yılında Ponpuak ve Deretic (3), otofajide fagozomların M. tuberculosis için bir ikamet vakuolünden daha fazlası olduğunu tanımladılar. Adaptör molekülü p62 veya sekestozom 1, fagozomal substratlarla etkileşime girer ve bozunma için zararsız sitozolik bileşenleri (ribozomal protein rpS30, öncü FAU ve ubikuitin) ayırır, kullanılan veya atılan materyalden antimikrobiyal peptitleri serbest bırakır. Bu, fagozoma lizozomal ve olgunlaşma özelliklerini verir; bu özellikler, hidrolazların yakalanması ve substratların ara mobilizasyonu ve bunların asitleştirilmesiyle birlikte, sonuçta onun gerçek bir otoizozom halinde füzyonuna yol açar. Bu dönüşümün sonucunun, açlık dönemlerinde geri dönüştürülecek serbest amino asitlerin sağlanması olduğu varsayımı böylece sorgulanıyor. O zamandan bu yana, bu sitozolik proteinlerin proteolizinin, antimikrobiyal güce sahip kriptik peptidlerin bir karışımıyla sonuçlandığı ve atılan biyolojik materyalden üretilen “kriptidler” adı verilen yeni doğal antibiyotikleri oluşturduğu açıklandı. Veya belirli zincir oluşumlarıyla ubikuitin etiketini taşıyan bakteriyel yüzey proteinleri, membrandan alınıp proteozomlara beslenebilir ve bakteriyel hücre duvarının bütünlüğünü ve sitozoldeki patojen içeriğinin yayılmasını ciddi şekilde tehlikeye atar(5). Kısacası, dönüşüm ve geri dönüşüm, imha edilmeye karşı müthiş dirençleriyle bilinen mikobakterilerin ortadan kaldırılması gibi değerli bir son işlevi geliştirir; Şekil 1'e bakınız.
Şekil 1
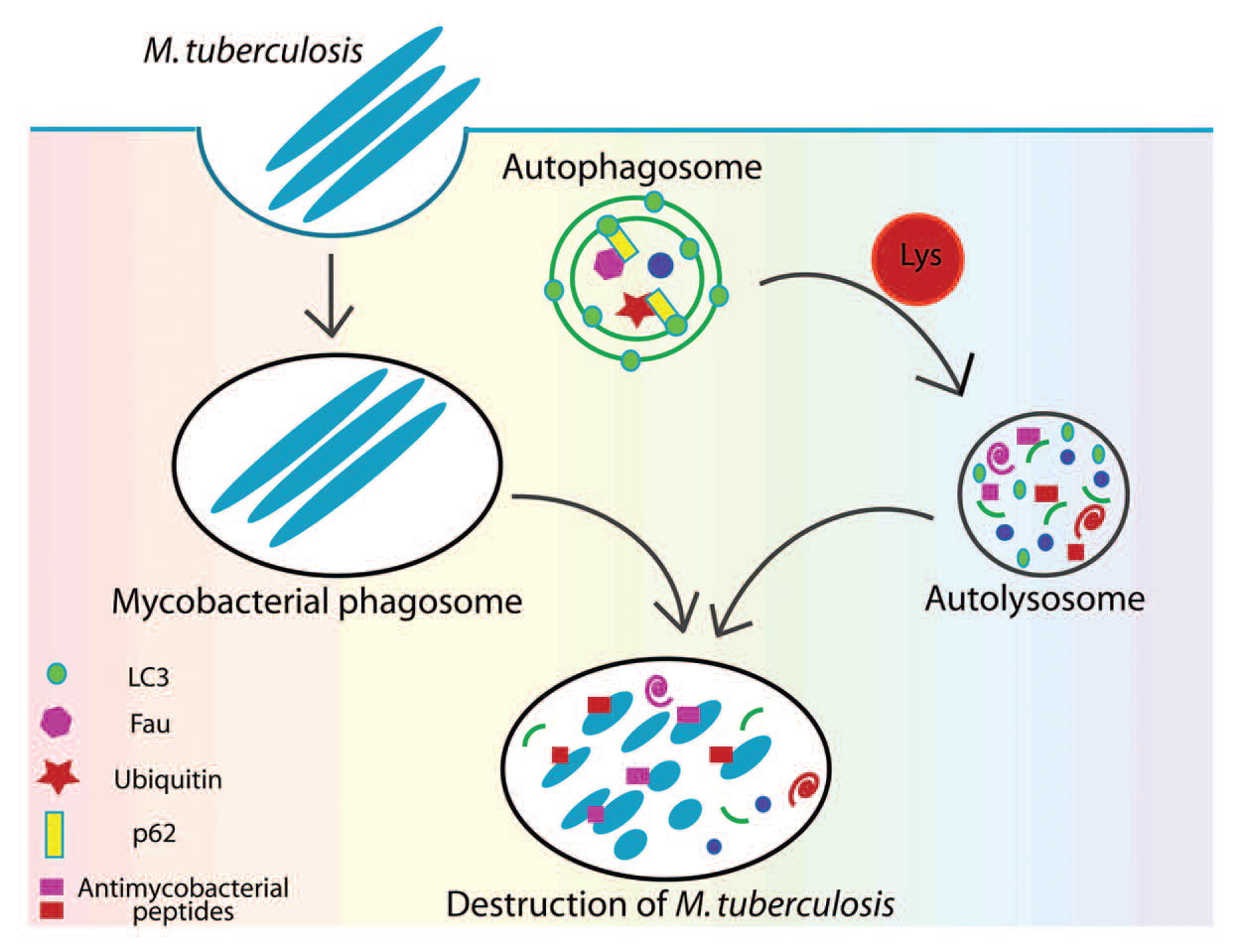 M. tuberculosis'in otofaji ve p62 yoluyla ortadan kaldırılması. Mycobacterium makrofajlar tarafından fagosite edilir ve fagozom içinde en azından bir süre kalır. Otofaji başlatıldığında, iki işlevli bir ajan olarak p62, otofajik substratlar ve LC3 ile etkileşime girerek ek olarak sitozolik substratları da ayırır. Otofagozom olgunlaşması ve hidrolaz yakalanması, tüm substratların bozunmasını ve bunların antimikrobiyal aktiviteye sahip peptitlere (kriptitler) dönüşmesini sağlar. (3)'ten alınmıştır
M. tuberculosis'in otofaji ve p62 yoluyla ortadan kaldırılması. Mycobacterium makrofajlar tarafından fagosite edilir ve fagozom içinde en azından bir süre kalır. Otofaji başlatıldığında, iki işlevli bir ajan olarak p62, otofajik substratlar ve LC3 ile etkileşime girerek ek olarak sitozolik substratları da ayırır. Otofagozom olgunlaşması ve hidrolaz yakalanması, tüm substratların bozunmasını ve bunların antimikrobiyal aktiviteye sahip peptitlere (kriptitler) dönüşmesini sağlar. (3)'ten alınmıştır
Şekil 2
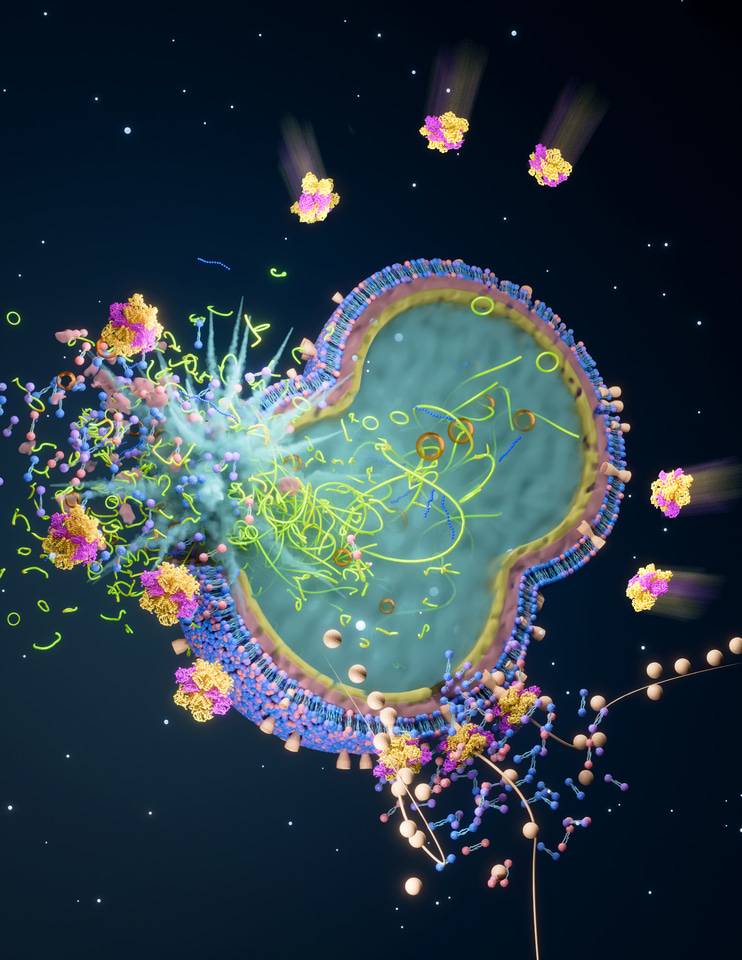 (5)'ten alınan bakteriyel toplama
(5)'ten alınan bakteriyel toplama
Mart 2025'te Goldberg ve ark. (2), katyonik özelliklere sahip kriptidlerin üretiminin aynı zamanda proteazomal fonksiyonda da meydana geldiğini açıklığa kavuşturdu; onlarca yıldır bu fonksiyonun, nükleer faktör kappa B'yi (NF-κB) aktive etmek veya Spt23p, Mga2p ve Epe1 gibi transkripsiyonel düzenleyici fonksiyonlara sahip protein öncülerini aktive etmek için histo-uyumluluk kompleksi I üretmek veya inhibitör proteinleri (IκB'ler) parçalamakla sınırlı olduğu düşünülüyordu. Ancak aynı zamanda ekstraksiyon kaynağının otofajide olduğu gibi sitozolden ekstrakte edilen substratlar içinde olduğunu da gösterdiler. Birinci dereceden evrimsel bir adım olmasının yanı sıra, antibakteriyel peptitler çok çeşitli doku ve hücrelerde bulunur ve bakterilere, mantarlara, virüslere ve bazı parazitlere karşı geniş spektrumlu aktivite gösterir. Katyonik etkilerine ek olarak konakçıdaki transkripsiyonel ve translasyonel aktiviteyi de modüle ederler. Bu peptitler Goldberg ve diğerleri tarafından proteazomdan türetilmiş peptitler (PSEI PDDP'ler) olarak adlandırılmıştır. Yapısal olarak üretilirler, ancak üretimleri enfeksiyona yanıt olarak da tetiklenebilir. Bir proteazom düzenleyici birim olan PSME3, katyonik terminallere sahip peptitleri artırarak triptik bozulmayı teşvik eder. Bu olgunun hesaplamalı analizleri, çoğu proteazom proteininin bu bozulmaya yatkın olduğunu ve dolayısıyla proteozomun PDDP üretimi potansiyelinin oldukça güçlü olduğunu göstermektedir. Bir Silico'da Kanıtlanmış antibakteriyel aktiviteye sahip peptitlerle yapısal karşılaştırmaya dayalı minimum etkinlik aralığıyla derecelendirilen, uzunlukları 10 ila 50 birim arasında amino asitler elde etmek için potansiyel bölünme bölgelerinin Pepsickle algoritması (4) kullanılarak tanımlanması, katyonik karboksil terminallerine sahip 270.872 varsayılan peptit tanımladı. Başka bir deyişle, açıklamalı genlerin %92'si katyonik terminale sahip en az bir peptid içerir. Bu, enfeksiyon riski olmadan doku yaralanmalarını tedavi etmek için otonom hücresel bağışıklığı tetiklemenin muazzam potansiyelini ve her spesifik vakada yer alan patojenlerle savaşmak için özel olarak tasarlanmış bir antimikrobiyal üretme olasılığının yüksek olduğunu göstermektedir. Bu yazıda poster olarak gösterilen makalenin Bağışıklık Sürekliliği'ne (Şekil 1) eklenecek bir başka melezlenmiş işlev, çok sayıda teklif aracılığıyla erken ve doğru bağışıklık özgüllüğü kavramını tanıtmaktadır. Birlikte ele alındığında, bir süreklilik olarak görülen enfeksiyona karşı direnci ve bağışıklığı geliştirmek ve sonunda bunun üstesinden gelmek için yeni düşünceler gereklidir.
Cubrisoft'un (makalede önerilen müdahale) otonom hücresel bağışıklık içindeki etki mekanizmasının tanımlanması ve bu ürünle tedavi edilen lezyonlarda enfeksiyonun düzenli olarak görülmemesi, Goldberg ve ark. tarafından açıklanan araştırmayla tutarlıdır. Kaynak tasarrufu, pervasız geç adaptif savunma tepkisinin aksine, sitozolik protein israfından ve düşük enerji harcamasından yararlanan erken direncin kalbinde yer alır(1). Bu kanıt, Cubrisoft'u, toksik veya istenmeyen etkiler olmaksızın yaralı dokulardaki enfeksiyonla mücadelede ön saflara yerleştirir ve “İleri iyileşme için hücrenin otonom yanıt penceresi” (1) bölümünde açıklanan rejeneratif onarım için en uygun koşulları yaratır.
Referanslar
1. Feoli -Tufi E, Redondo GM, Flores JS, Jara DP. Gelişmiş iyileşme için hücrenin otonom yanıt penceresi. Med'i Keşfet [Internet]. 10 Ekim 2025 [cited November 9, 2025];2(1):1-42. Şuradan temin edilebilir: https://link.springer.com/article/10.1007/s44337-025-00478-4
2. Goldberg K, Lobov A, Antonello P, Shmueli MD, Yakir I, Weizman T, ve diğerleri. Proteazomdan türetilmiş savunma peptidleri ile hücre-otonom doğuştan gelen bağışıklık. Doğa [Internet]. Mart 2025 [cited 2025 Nov 9];639(8056):1032-41. Şu adreste mevcuttur: https://www.nature.com/articles/s41586-025-08615-w
3. Ponpuak M, Deretic V. Otofaji ve p62/sekestozom 1, sitozolik proteinlerden neo-antimikrobiyal peptitler (kriptitler) üretir. Otofaji [Internet]. 1 Mart 2011 [cited November 9, 2025];7(3):336-7. Şuradan temin edilebilir: https://doi.org/10.4161/auto.7.3.14500
4. Weeder BR, Wood MA, Li E, Nellore A, Thompson RF. Pepsickle, gelişmiş neoantijen tanımlaması için proteazomal bölünme bölgelerini hızlı ve doğru bir şekilde tahmin eder. Biyoenformatik [Internet]. Eylül 2021;37(21):3723-33. Şu adreste mevcuttur: https://doi.org/10.1093/bioinformatics/btab628
5. Ghosh Sourav, Roy Suvapriya, Baid Navin. Konakçı AAA-ATPase VCP/p97, doğuştan gelen bir antimikrobiyal savunma olarak her yerde bulunan hücre içi bakterileri yok eder. Doğa Mikrobiyolojisi 2025; 10(5):1099–1114 Şu adreste bulunabilir: https://www.nature.com/articles/s41564-025-01984-y?utm_campaign=tained_content&utm_source=HEALTH&utm_medium=communities
Bir yanıt yazın