Kement şeklindeki lipopeptitler (uzun bir yağ asidi kuyruğu taşıyan makrosiklik peptitler), daptomisin ve kolistin gibi büyüleyici bir antibiyotik sınıfını temsil eder. Bakteriyel hücre yüzeyindeki hedefler üzerinde etkili olurlar, ancak karmaşık mimarileri kimyasal sentezi son derece zorlaştırır. Doğanın kendi biyosentetik mekanizmasının bu karmaşık molekülleri daha basit ve modüler bir şekilde oluşturmak için kullanılıp kullanılamayacağını merak ettik.
Siklazları Yanlara Çevirmek
Ribozomal olmayan peptit sentetazları (NRPS'ler), kement şeklindeki lipopeptitler de dahil olmak üzere yapısal olarak çeşitli peptitler üreten, doğadaki büyük çoklu enzim düzenekleridir.[1] Tiyoesteraz (TE) alanları, makrosiklik bir yapı iskelesi oluşturmak için peptid zincirini kapatarak son siklizasyon aşamasını katalize eder. Pek çok araştırmacı TE'leri peptit siklizasyonu için biyokatalizörler olarak araştırdı; ancak kement oluşturan TE'ler tipik olarak dar substrat spesifikliği gösterir ve çeşitli kement peptidleri oluşturmak için kolaylıkla uygulanamaz. [2]
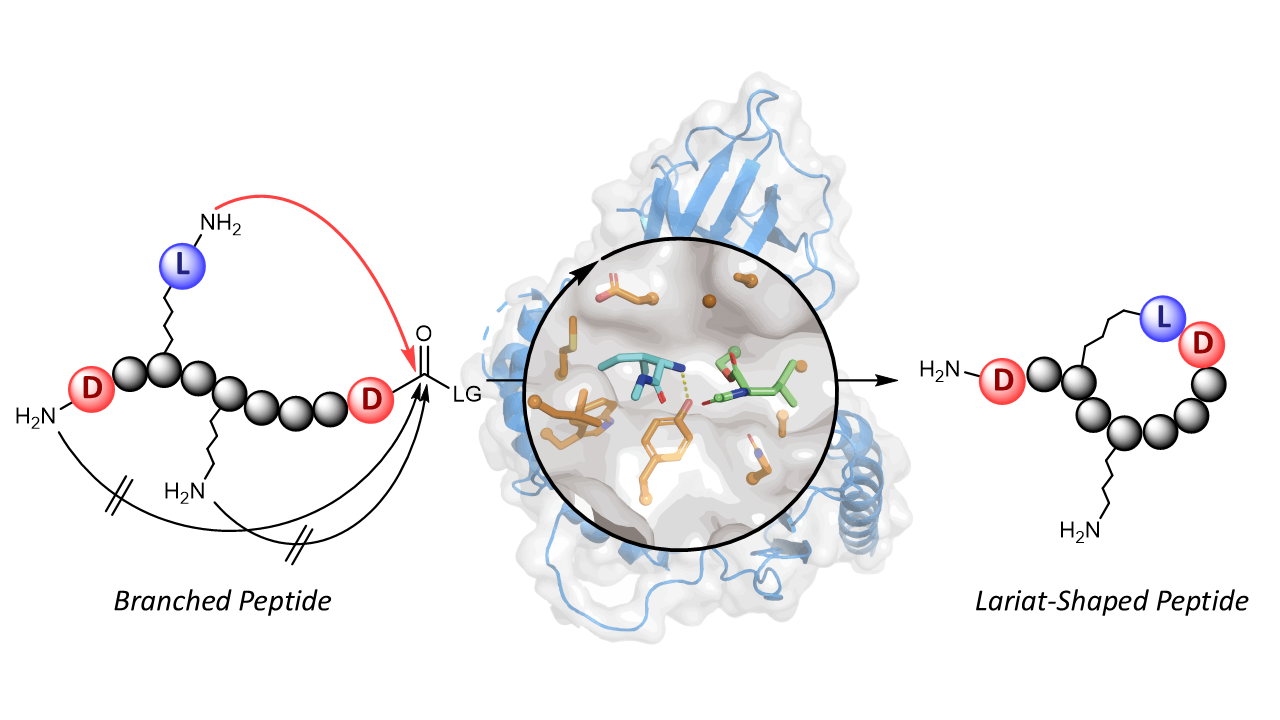
Ekibimiz daha önce, ribozomal olmayan peptid siklazların yeni tanımlanmış bir enzim ailesi olan penisilin bağlayıcı protein tipi tioesterazları (PBP tipi TE'ler) keşfetmişti. [3,4] Bu PBP tipi TE'ler, in vitro olarak çok çeşitli siklik peptitler üretebilen üretken biyokatalizörlerdir (Şekil a). [5] Bununla birlikte, her iki peptit ucunu birleştirerek baştan kuyruğa makrosiklizasyonu özel olarak katalize ederler; bu, kement peptit sentezi için çok yönlü bir biyokatalitik yaklaşımın bilinen NRPS siklazların erişiminin ötesinde kaldığı anlamına gelir.
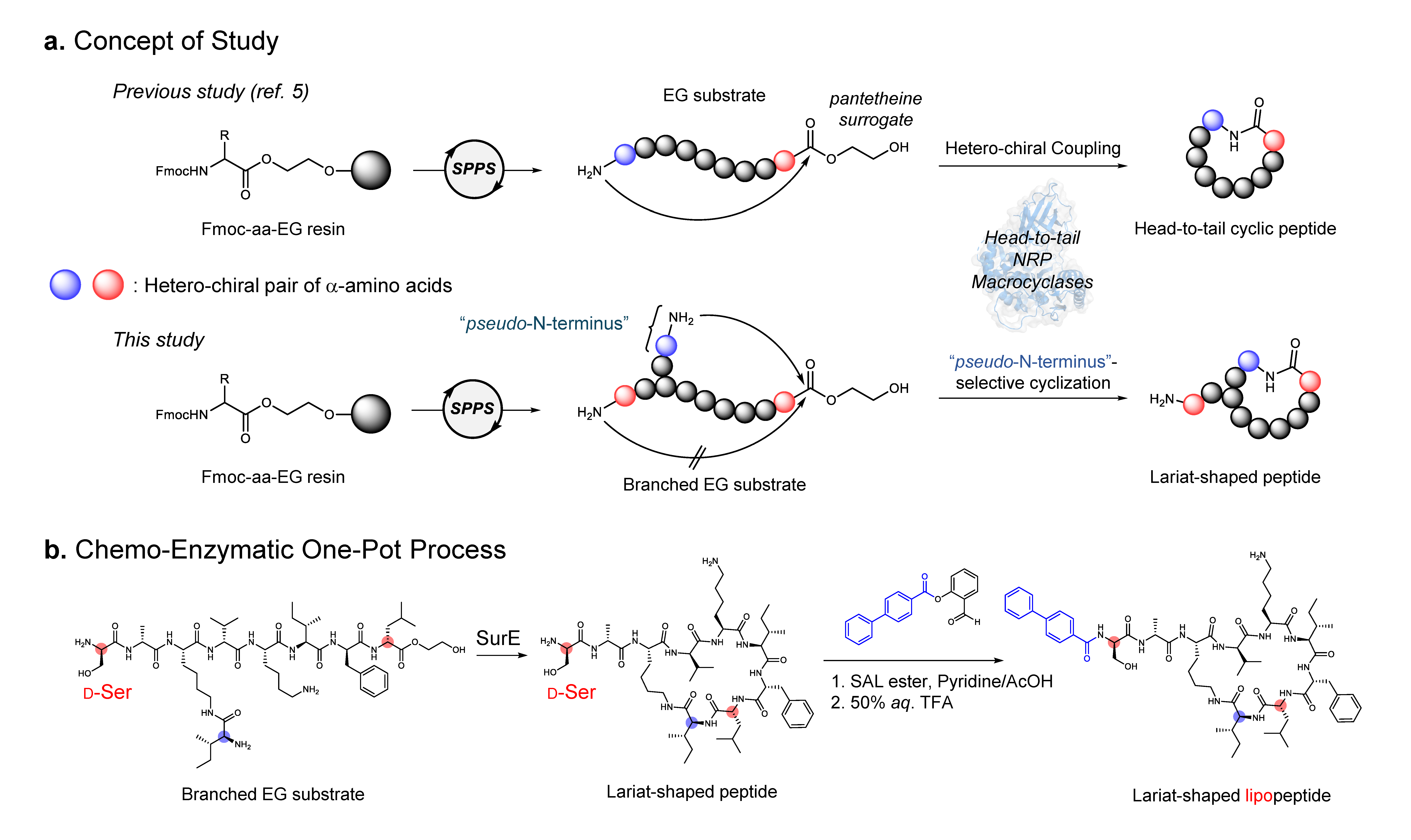
Bu çalışmada bildirilen Doğa Kimyası “Lariat Lipopeptitlerinin Ribozomal Olmayan Peptid Siklazlara Yönelik Kemoenzimatik Sentezi” (https://www.nature.com/articles/s41557-025-01979-6) başlıklı çalışmamızla, çok yönlü bir baştan kuyruğa siklazı yeni bir görev için yeniden programlamayı amaçladık: lariat peptid sentezi. Enzimin kendisini kapsamlı bir şekilde tasarlamak yerine substratını yeniden tasarlamaya odaklandık. Bir “tanıtaraksözdePeptit yan zinciri içinde ek bir N-terminus içeren bir dipeptit birimi olan “-N-terminus” ile siklizasyon için iki olası bölge oluşturduk. Dikkat çekici bir şekilde, SurE enzimi yalnızca geleneksel baştan kuyruğa makrosikli değil aynı zamanda kement şeklinde bir peptit üretti. Bu basit substrat yeniden tasarımı, baştan kuyruğa siklazın kement peptitleri oluşturmak için etkili bir şekilde yeniden tasarlanabileceğini gösterdi (Şekil b).
Stereokimyasal Anahtar
Layat peptid oluşumunu ayrıcalıklı kılmak için stereokimyasal kontrole yöneldik. PBP tipi TE'ler yalnızca L-yapılandırılmış nükleofilleri kabul ettiğinden, peptidin orijinal N-terminal kalıntısının ayna görüntüsündeki d-amino asitle değiştirilmesi, tipik baştan kuyruğa yolunu etkili bir şekilde bloke etti. Bu, enzimi kullanmaya zorladı. sözdeNükleofil olarak -N-ucu, tam seçiciliğe sahip kement peptidleri verir.
İlginçtir ki bu strateji tek bir enzimle sınırlı değildi. WolJ ve TycC-TE gibi diğer makrosiklazlar da benzer uyarlanabilirlik sergiledi. Her biri, herhangi bir protein mühendisliği olmadan, yalnızca substrat tasarımı yoluyla kement makrosiklleri oluşturacak şekilde yeniden kullanılabilir.
Lipopeptitlere ve Aşağı Yöndeki Değerlendirmeye Giden Tek Kaplı Bir Yol
Enzimatik dönüşümler yüksek seçicilikle ilerlediği için, ortaya çıkan reaksiyon karışımları, sonraki modifikasyon veya biyolojik değerlendirmeden (örn. antimikrobiyal test) önce ürün izolasyonunu atlayacak kadar saftır ve iş akışını önemli ölçüde kolaylaştırır.
Lariat lipopeptitler sadece makrosiklik başlarıyla değil aynı zamanda biyolojik aktivite için gerekli olan lipofilik kuyruklarıyla da karakterize edilir. Bu özellikleri entegre etmek için enzimatik makrosiklizasyonu, siklizasyonda kullanılmayan serbest N terminalini hedef alan bölge seçici bir asilasyon reaksiyonu olan serin/treonin ligasyonu (STL) ile birleştirdik. Dikkat çekici bir şekilde, her iki reaksiyon da (siklizasyon ve asilasyon) ılımlı koşullar altında tek bir kapta sırayla ilerleyerek ara saflaştırmayı ortadan kaldırdı ve kement lipopeptitlerin verimli paralel sentezini mümkün kıldı. Bu kolaylaştırılmış süreç, antimikrobiyal aktivite açısından doğrudan taranabilen 51 üyeli bir kement lipopeptit kütüphanesi oluşturdu. Mycobacterium intraselüler, Mikobakteri absesi, Stafilokok aureusVe Escherichia coli. Bu bileşiklerin sekizi inhibe edildi M. hücre içi 8-16 μg ml konsantrasyonlarda %50 büyüme-1.
Genel olarak bu çalışma, belirli ribozomal olmayan peptit siklazların dikkat çekici katalitik karışıklığını vurgulamakta ve doğal ürün benzeri bileşik kütüphanelerine erişmek için bu tür biyosentetik enzimlerden yararlanmanın ve sonuç olarak hızlı isabet keşfine olanak sağlamanın avantajlarını vurgulamaktadır. Doğa, moleküler dönüşümün olağanüstü karmaşık yollarını geliştirmiştir (peptit siklazlarla örneklendiği gibi, ancak bunlarla sınırlı değildir) ve bu mekanizmalar, sentetik amaçlara yönelik araçlar olarak şüphesiz daha derin araştırmaları hak etmektedir.
Referanslar
- Süssmuth, RD, Mainz, A. Ribozomal olmayan peptid sentezinin ilkeleri ve beklentileri. Angew. Kimya, Uluslararası Ed. İngilizce 563770–821 (2017).
- Matsuda, K. Bakteriyel ribozomal olmayan peptid biyosentezinde makrosiklikleştirici-tiyoesterazlar. J. Nat. Med. 791–14 (2025).
- Kuranaga, T., Matsuda, K., Sano, A., ve diğerleri. Ribozomal olmayan peptid surugamid B'nin toplam sentezi ve yeni bir boşaltma siklaz ailesinin tanımlanması. Angew. Kimya, Uluslararası Ed. İngilizce. 579447–9451 (2018).
- Matsuda, K., Zhai, R., Mori, T., ve diğerleri. Ribozomal olmayan peptid makrolaktamizasyonunda heterokiral bağlanma. Nat. Katal. 3507–515 (2020).
- Kobayashi, M., Fujita, K., Matsuda, K., Wakimoto, T. Ribozomal olmayan peptid siklazlarla siklik peptidlerin kolaylaştırılmış kemoenzimatik sentezi. J. Am. Kimya Sos. 1453270–3275 (2023).
Bir yanıt yazın